日前,国际著名期刊美国科学院院报(PNAS)在线发表了我校学院•整合学院朱家鹏教授团队与耶鲁大学、伊利诺伊大学香槟分校以及哥伦比亚大学合作的的最新研究成果“Cryo-EM structures of Escherichia coli cytochrome bo3 reveal bound phospholipids and ubiquinone-8 in a dynamic substrate binding site”,该研究是朱家鹏教授团队于2019年12月30日在PNAS杂志上发表的“Structure of the cytochrome aa3-600 heme-copper menaquinol oxidase bound to inhibitor HQNO shows TM0 is part of the quinol binding site”工作的延续。
在生物细胞内的氧化过程中,呼吸链的最后一个酶将氧气还原成水,同时向胞外泵出质子、形成跨膜质子梯度以驱动ATP产生。大多数这样的酶,例如线粒体中的细胞色素c氧化酶,接受被bc1 complex还原的细胞色素c(cyt c)的电子将氧气还原成水。在细菌中,有一类被认为从细胞色素c氧化酶进化而来的Quinol Oxidase能直接接受还原态醌醇(甲萘酚menaquinol或泛醌ubiquinol)的电子,将氧气还原成水。
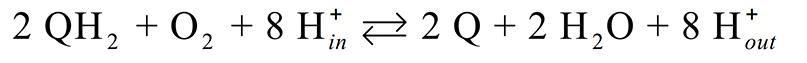
该研究解析了大肠杆菌中cytochrome bo3氧化酶高分辨率的冰冻电镜结构,并第一次清晰的揭示了该酶的活性中心与底物泛醌的结合方式。该结构的提供了一个清晰的蓝图,促进我们更好的理解这类Quinol Oxidase的工作机理。
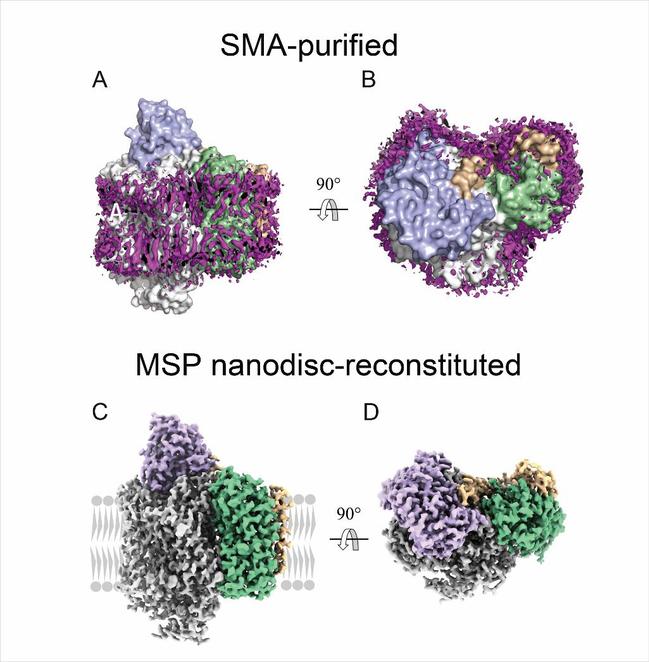
图一 cytochrome bo3的整体结构
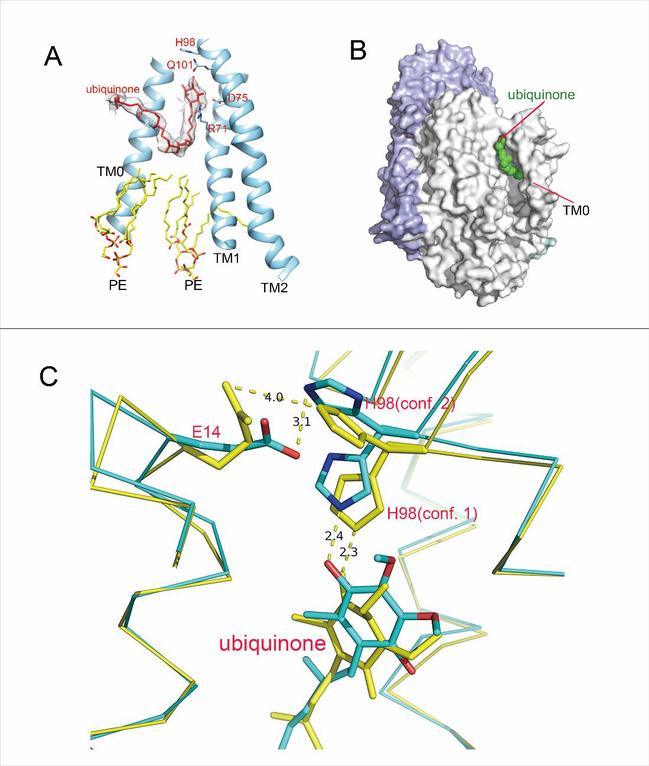
图二 Ubiquinone的结合位点
朱家鹏教授课题组的李姣博士是该论文的第一作者,朱家鹏教授是共同通讯作者,青年教师刘冰以及硕士研究生罗炎梅参与了该项目,澳门新莆京5088app官网为第一通讯单位。该项研究得到国家重点研发计划项目(2020YFA0509400)、江苏省中西医结合优势学科建设项目专项经费、江苏省自然科学基金青年科学基金项目(BK20190806)等资助。
论文链接:https://www.pnas.org/content/118/34/e2106750118。
