近日,学院学院韩欣教授团队先后在国际知名学术期刊Acta Pharmaceutica Sinica B(中国科技期刊卓越行动计划重点期刊,中科院医学一区,IF: 14.911),Biosensors and Bioelectronics(中科院工程技术一区,IF:12.545)和Journal of Experimental & Clinical Cancer Research(中科院医学一区,IF: 12.658)在线发表关于CRISPR基因编辑技术在疾病基因治疗、体内诊断和成像以及靶向肿瘤干细胞异质性的临床诊疗方向的最新研究成果。
韩欣教授课题组在Acta Pharmaceutica Sinica B期刊上在线发表题为 “Tumor-Microenvironment Activated Duplex Genome-Editing Nanoprodrug for Sensitized Near-infrared Titania Phototherapy”的文章,该工作通过巧妙设计微环境响应型基因编辑纳米体系用于肿瘤的光疗增敏治疗,从而实现精准智能搏杀癌症的目的。与常规肿瘤治疗策略(化疗、放疗等)相比,近/远红外光控癌症治疗(光动力、光热疗法等)具有非入侵特性和更高的选择性,能够在最大程度上降低药物、射线等对正常机体的损伤作用,但是光疗仍会在肿瘤部位触发相当程度的细胞应激信号来抵抗外力干预。例如,在几种关键蛋白质(如核因子E2相关因子2(NRF2)、热休克蛋白90(HSP90)、缺氧诱导因子1(HIF-1)等)的介导下,肿瘤组织可以在一定程度上减缓氧化/热应激等反应引起的细胞杀伤作用,从而提高癌细胞在恶劣微环境下的存活和增殖能力。因此,抑制此类关键蛋白的肿瘤保护作用可以在临床肿瘤治疗中增敏光疗效果,实现低剂量光照有效杀伤肿瘤的目标并同时降低了治疗带来的毒副作用。目前针对这些重要靶点的抑制剂大都是一些小分子药物,这些药物大都存在耐药性和重复给药等问题,这无疑增加了肿瘤复发和治疗相关毒性的风险,严重影响患者的生活质量。作为一项新兴的基因治疗策略,CRISPR基因编辑技术可以通过永久改变致癌或抑癌基因的表达水平来治疗癌症,有效克服传统肿瘤治疗过程中存在的耐药和重复给药等问题。然而,如何精确靶向特定细胞类群、诱导对治疗有效的基因编辑水平一直以来都是制约基因编辑疗法最终能否走向临床应用的关键因素和技术瓶颈。

针对以上关键科学和技术问题,澳门新莆京5088app官网韩欣教授联合南京大学宋玉君教授、江苏省人民医院管晓翔教授,基于缺陷二氧化钛(TiO2-x)多功能纳米载体成功构建了肿瘤微环境响应型的CRISPR基因编辑纳米系统,实现了近红外光触发的黑色素瘤光疗增敏和癌症杀伤效果。在这个智能响应性的基因编辑纳米治疗体系里, 包裹在载体表面的透明质酸(HA)和共价连接Cas9蛋白于TiO2-x表面的二硫键(S-S)分别负责响应肿瘤微环境中的透明质酸酶(HAase)和谷胱甘肽(GSH)。当该纳米药物进入肿瘤微环境后,肿瘤部位富集的HAase和GSH可轻易破坏其表面的透明质酸和内部的二硫键,释放出Cas9/sgRNA蛋白复合体进行特定部位的基因编辑。近红外光刺激能够激活功能化的TiO2-x纳米粒子,使其同时具备光动力治疗(PDT)和光热治疗(PTT)效果。为了进一步提高肿瘤光疗效果和降低毒副作用,该体系通过双靶向NRF2和HSP90α基因编辑分别提高肿瘤PDT和PTT的耐受敏感度,即采用低剂量的光照就可以同时提高肿瘤细胞的ROS水平以及降低肿瘤细胞的光热耐受性,达到“一石二鸟”的治疗功效。该研究通过基因编辑靶向应激(氧化/热)缓解调节因子(NRF2/HSP90α),降低肿瘤细胞对于外力干预治疗的应激耐受性,为通过阻断应激信号通路实现有效杀伤肿瘤同时降低毒副作用的癌症临床治疗提供了新的策略和方法。另外,该工作也实现了肿瘤微环境响应性的双靶标基因敲低,为靶向特定细胞类群的精准基因编辑和癌症等疾病的精准医疗提供了新的工具。硕士研究生李泽昆为该论文的第一作者,韩欣教授为最后通讯作者,该项研究获得国家自然科学基金项目(31901010, 21874066, 81601632)、江苏高校优势学科建设工程资助项目(中西医结合)、江苏省特聘教授自然科学类资助人才项目、江苏省“双创计划”团队项目、江苏省中药资源产业化过程协同创新中心重点项目(ZDXM-2020-12)等资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S2211383522003112
同时,课题组还在Biosensors and Bioelectronics期刊在线发表题为“Hollow covalent organic framework-sheltering CRISPR/Cas12a as an in-vivo nanosensor for ATP imaging”的文章,该工作通过设计中空共价有机框架(COFs)包裹的酶催化体系实现了基于CRISPR/Cas12a技术的体内高效、稳定的ATP成像和检测。该方法通过制备COFs对关键酶进行封装以进行保护和体内递送,不仅有助于基于CRISPR-Cas系统在疾病检测领域的开发和拓展,同时也可以广泛应用于其他蛋白质在临床诊断、医学研究和仿生纳米器件中的工作场景,韩欣教授为该文章的共同通讯作者。
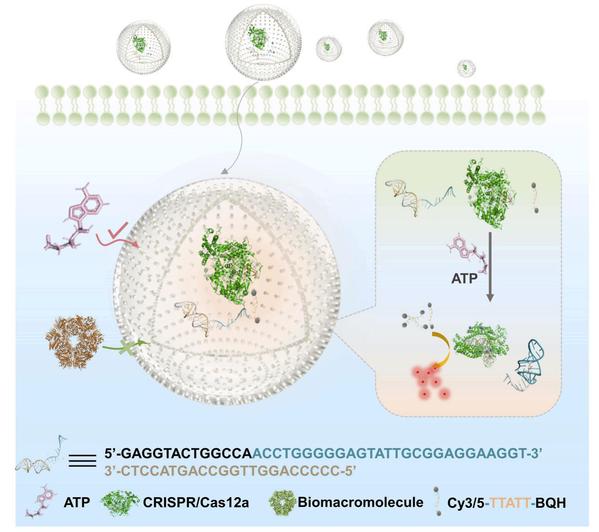
原文链接:https://www.sciencedirect.com/science/article/pii/S0956566322002792?via%3Dihub
此外,课题组还在Journal of Experimental & Clinical Cancer Research期刊在线发表题为“Heterogeneity of BCSCs contributes to the metastatic organotropism of breast cancer”的综述文章,该论文讲述了乳腺癌肿瘤干细胞异质性对于肿瘤转移器官选择性的影响,同时也总结和评估了基于BCSCs相关肿瘤疗法临床试验的安全性和有效性,对晚期转移性乳腺癌的诊断和治疗提供了新的见解和思路,韩欣教授为该文章的共同通讯作者。
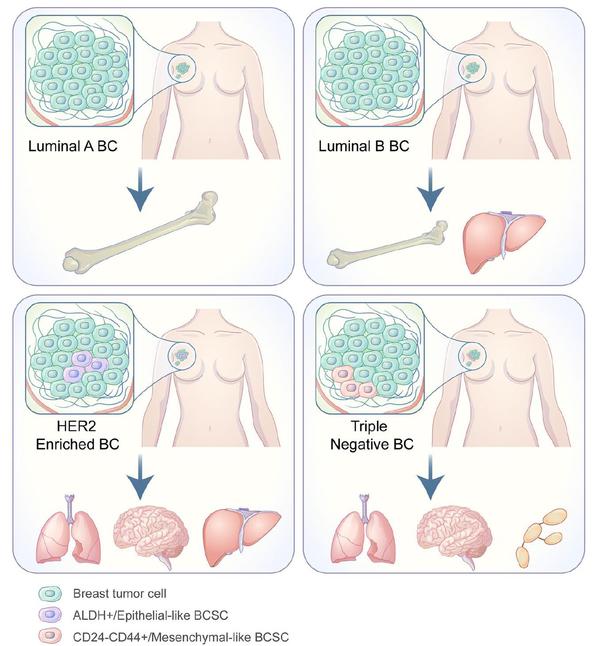
原文链接:https://jeccr.biomedcentral.com/articles/10.1186/s13046-021-02164-6?elqTrackId=ebe2166f542c479382499a84b4ed802f
韩欣教授课题组主要从事微流控芯片技术与转化医学、生物材料与基因编辑递送方向的研究,近2年相关成果以通讯作者发表在中科院1区且影响因子大于10的文章7篇(Small, Biomaterials, Angewandte Chemie, Acta Pharmaceutica Sinica B, Advanced Healthcare Materials, Biosensors and Bioelectronics, Journal of Experimental & Clinical Cancer Research),其中包括两篇封面文章,申请发明专利2件,申请PCT国际专利1件。
