近日,国际期刊Angew. Chem. Int. Ed.(中科院综合性期刊1区,IF:16.6)在线发表了我校学院韩欣教授、杨婧婧副教授课题组及南京大学宋玉君教授课题组的最新研究成果Bioorthogonal Reaction-Mediated Tumor-Selective Delivery of CRISPR/Cas9 System for Dual-Targeted Cancer Immunotherapy。
近年来,CRISPR系统辅助的免疫疗法在癌症治疗领域引来越来越多的关注。然而,限于缺乏有效的CRISPR/Cas肿瘤靶向递送工具,其疗效仍然低于预期。日前,澳门新莆京5088app官网韩欣教授团队与南京大学宋玉君教授团队合作,利用生物正交反应实现CRISPR/Cas9系统在肿瘤部位的靶向富集,并通过全面激活固有和适应性抗肿瘤免疫,重塑肿瘤免疫微环境,实现良好的抗肿瘤效果。
论文作者借助具有高药物负载效率及肿瘤微环境响应性质的空心二氧化锰纳米材料(H-MnO2),实现了对肿瘤部位的选择性叠氮化标记。该标记策略可克服天然标志物受体数量有效的缺点,亦可对缺少特异性标志物的肿瘤组织进行改造。同时,H-MnO2降解产生的Mn2+可通过增强cGAMP与STING结合的亲和力来增强肿瘤细胞中干扰素基因刺激物(STING)的活性,通过介导天然免疫系统中的I型干扰素(IFN-I)和促炎因子释放增强抗癌免疫反应,并重塑肿瘤免疫微环境。随后,负载CRISPR/Cas9系统的脂质纳米材料通过生物正交反应聚集在肿瘤组织,提高了CRISPR系统在肿瘤部位的积累和基因编辑活性,减少对非目标器官的编辑效应。同时,通过敲低肿瘤部位免疫细胞及肿瘤细胞中蛋白酪氨酸磷酸酶N2基因,促进杀伤性T细胞增殖并增强肿瘤细胞对IFN-γ等肿瘤杀伤因子的敏感性,进一步增敏肿瘤的免疫治疗。总体而言,这种策略为实现体内精准的基因编辑提供了一个模块化的平台,并通过重塑肿瘤免疫微环境引发良好的抗肿瘤反应,为CRISPR技术用于肿瘤免疫治疗转化应用提供了有力支撑。
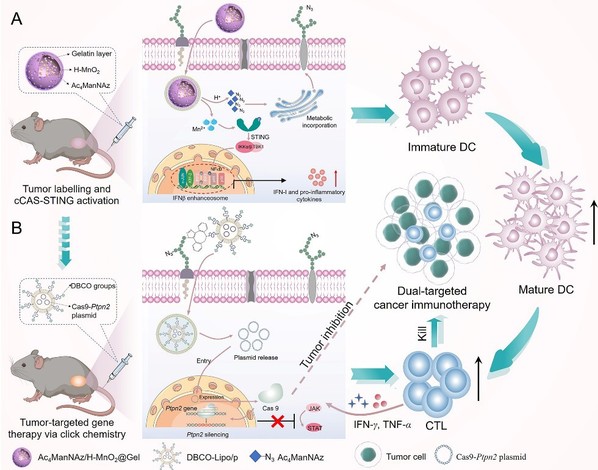
通过生物正交反应实现CRISPR/Cas系统的靶向递送及级联免疫激活示意图
文章的第一作者为澳门新莆京5088app官网副教授杨婧婧及青年教师杨开勇,澳门新莆京5088app官网韩欣教授及南京大学宋玉君教授为该论文的共同通讯作者,澳门新莆京5088app官网为第一通讯单位。
论文信息:
https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202306863
Bioorthogonal Reaction-Mediated Tumor-Selective Delivery of CRISPR/Cas9 System for Dual-Targeted Cancer Immunotherapy
Jingjing Yang, Kaiyong Yang, Shiyu Du, Wen Luo, Prof. Chao Wang, Dr. Hongmei Liu, Kunguo Liu, Zhibin Zhang, Yanfeng Gao, Xin Han, Yujun Song
Angew. Chem. Int. Ed. 2023, e202306863, DOI: 10.1002/anie.202306863
(撰稿人:杨婧婧 ;审核人:关晓伟)
